فرایند اصلی در ترسیب الکتریکی
در این بخش به بررسی ترسیب الکتریکی در آبکاری فلزات می پردازیم .
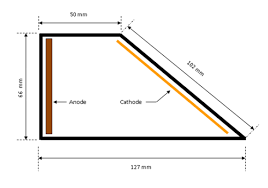
فرآیند ترسیب الکتریکی اساسا شامل انتقال جریان الکتریکی بین دو الکترود غوطه ور در یک محلول الکترولیت است . الکترود با بار مثبت در نقش آند و الکترود با بار منفی در نقش کاتد است . محلول الکترولیت شامل ذرات یا یون های حامل بار الکتریکی است . هنگامی که یک پتانسیل یا ولتاژ بین الکترود ها اعمال می شود این یون ها به سمت الکترود با بارمخالف حرکت می کنند . یون های حاوی بار مثبت به سمت کاتد و یون های حئای بار منفی به سمت آند حرکت می کنند و به این ترتیب مدار الکتریکی در محلول هم کامل می شود . انرژی الکتریکی از طریق یک منبع تغذیه DC تامین می شود . عموما در آبکاری ، آند ها از جنس فلزاتی که قرار است ترسیب شوند ، ساخته می شوند که به آن ها آند های حل شونده گفته می شود . در طی آبکاری کاتیون های فلزی در سطح کاتد ترسیب می شوند . بنابراین قسمت آبکاری شده پوشش فلز را به خود می گیرد و عکس این اتفاق در آند می افتد ، در یک آند محلول ، یون های فلزی از ساختار کریستالی آند به محلول الکترولیت وارد می شود یعنی درواقع آند حل می شود . در آبکاری نیکل الکترولیت حاوی نمک های نیکل همراه با سایر اجزای تشکیل دهنده می باشد . نمک های نیکل به یون های نیکل با دو بار مثبت و یون های منفی در الکترولیت یونیزه می شوند . با برقراری جریان الکتریکی یون های مثبت با دو الکترون واکنش داده و تبدیل به نیکل فلزی شده و این نیکل فلزی در سطح کاتد ترسیب می شود . از طرفی آند ، نیکل فلزی به فرم دو طرفیتی در الکترولیت حل شده و به صورت یون های مثبت در محلول الکترولیت حرکت می کند . در واقع یون های نیکل در کاتد تخلیه و دوباره با آند شارژ می شوند .
سرعت رسوب گذاری
مایکل فارادی در امور تحقیقاتی خود در زمینه ترسیب الکتروشیمیایی ثابت کرد که میزان ترسیب فلز در کاتد و میزان حل شدن آن در آند یک نسبت مستقیم با جریان برق عبور داده شده وزمان دارد . فارادی برای این منظور مقدار مشخصی از یک فلز ترسیب شده یا حل شده با وزن اتمی مشخص را بررسی کرد و این عدد را با تعداد الکترون های درگیر در واکنش الکتروشیمیایی مقایسه کرد. فارادی نشان داد که میزان جریان جریان برق مورد نیاز برای ترسیب یا حل شدن یک اکی والان از یک فلز یک عدد ثابت و معادل 96500 کولن یا 26.799 A.h است که به ثابت فارادی معروف است . با استفاده از این روابط می توان نشان داد که وزن یکل در کاتد و مقدار نیکل حل شده در آند از رابطه زیر بدست می آید :
W=1.095 It
در این رابطه W میزان نیکل ترسیب شده در کاتد یا حل شده از آند برحسب گرم ، I جریان عبوری بر حسب آمپر و t زمان آبکاری برحسب ساعت می باشد .در این رابطه فرض می شود که همه جریان الکتریکی به طور موثر در ترسیب و انحلال نیکل استفاده می شود . ( یعنی بازده کاتدی 100 درصد است ) فاکتور 1.095 حاصل کار فارادی و ثابت فارادی نامیده می شود . وزن اتمی نیکل 58.70 و ظرفیت اکسایشی آن 2 است . بنابراین وزن اکی والان نیکل برابر29.35 است . به این ترتیب 26.799 جریان الکتریکی ، 29.35 گرم از نیکل و یا 1.095 g/A.h نیکل را ترسیب خواهد کرد در نتیجه اگر جریان موثر 100 درصد باشد ، 1A.h مقدار 1.095 گرم نیکل را ترسیب یا به عبارتی حل می کند .